
ARTÍCULO ORIGINAL
Revista Científico estudiantil Ciencias Forestales y Ambientales.
Enero - Junio 2020; 5(1):9-20

Influence of storage time on the seeds physiological quality of Pinus caribaea Morelet var. caribaea Barret and Golfari from Malas Aguas clonal orchard
Lidia María Dorta Hidalgo
Universidad de Pinar del Río "Hermanos Saíz Montes de Oca". Cuba. Correo electrónico: lidia.dortah@upr.edu.cu
Recibido: 02 de diciembre 2019
Aprobado: 02 de febrero de 2020
RESUMEN
Con el objetivo de analizar la influencia del tiempo de almacenamiento sobre la calidad fisiológica de semillas de P. caribaea, se realizaron pruebas químicas (conductividad eléctrica), bioquímicas (tetrazolio e índigo carmín) y de germinación a semillas procedentes del Huerto clonal Malas Aguas colectadas desde el año 2014 hasta el 2017. El análisis estadístico no evidenció existencia de diferencias significativas de calidad entre los años aunque el lote del año 2016 tuvo el mejor comportamiento. Se comprobó que la especie pierde cerca del 50% de su capacidad germinativa transcurrido dos años de almacenamiento indicando que deben ser usadas una vez beneficiadas.
Palabras clave: Pinus caribaea; calidad fisiológica; almacenamiento de semillas.
ABSTRACT
In order to analyze the influence of storage time on the seeds physiological quality of P. caribaea, chemical (electrical conductivity), biochemical (tetrazolium and indigo carmine) and germination tests were carried out with seeds from the Malas Aguas clonal orchard collected since the year 2014 to 2017. The statistical analysis did not verify the existence of significant differences of quality between the years although the lot of 2016 had the best behavior. It was found that the species lose about 50% of its germination capacity after two years of storage indicating that they should be used once benefited.
Key words: Pinus caribaea; physiological quality; seed storage.
INTRODUCCIÓN
Las especies de pinos, después de las de eucalipto, son las más ampliamente plantadas a nivel mundial por su crecimiento relativamente rápido y sobre todo su capacidad de desarrollarse en una amplia variedad de condiciones edafo-climáticas.
P. caribaea constituye una especie priorizada en los planes de reforestación en Cuba y por tanto ha sido una prioridad la obtención de semillas con alta calidad genética y fisiológica, es así que desde los años 60 se comenzaron los trabajos de selección y mejoramiento genético para la creación de fuentes de semillas (Pérez-Santana et al., 2011).
La calidad de una muestra de semillas frecuentemente varía ampliamente dependiendo de su origen, nivel de maduración, grado de parasitismo y depredación, limitaciones de recursos para la reproducción dentro del año de colecta y las técnicas de recolección y manejo que se hayan empleado. La calidad de las semillas recolectadas tiene gran importancia, ya que las semillas de baja calidad no resisten el almacenamiento o no germinan tan bien como aquellas colectadas con más cuidado (Sotolongo et al, 2010).
La mejor manera de corroborar la viabilidad de un lote de semilla es con una prueba de germinación, que tiene el inconveniente de que requiere, en la mayoría de los casos, excesivo tiempo para la observación de los resultados (Benito-Matías et al., 2004), aunque existen otros procedimientos como la determinación de la conductividad electrolítica, las pruebas del tetrazolio y de índigo carmín, que aunque más complicados son buenos indicadores del estado fisiológico de las semillas.
El Huerto clonal semillero de Malas Aguas representa el avance genético alcanzado después de 40 años de mejoramiento. Sin embargo, en la actualidad tiene serias limitaciones en la producción de semilla que no rebasa los niveles de hace más de 10 años. Por otro lado, la producción de conos y semillas, así como los certificados de calidad de los lotes semilleros muestran una reducción tanto en la cantidad de semilla como en la capacidad germinativa de la ésta (Pozo, 2016, Pérez, 2016; Jiménez, 2017).
Es objetivo de este trabajo evaluar, a partir de pruebas químicas, bioquímicas y de germinación, el efecto del tiempo de almacenamiento de lotes de los años desde el 2014 hasta el 2017 sobre la calidad fisiológica de las semillas del Huerto.
MATERIALES Y MÉTODOS
El Huerto clonal de Malas Aguas pertenece a la EAF Minas de Matahambre en la provincia de Pinar del Río. Tiene 187 ha y cuenta con más de 87 clones superiores de P. caribaea.
Para el estudio se tomaron muestras de lotes de semillas de los años 2014, 2015, 2016 y 2017 lo que da cuatro niveles de tiempo de almacenamiento:
Año de colecta |
Tiempo de almacenamiento (años) |
2014 |
3 |
2015 |
2 |
2016 |
1 |
2017 |
Recién colectadas |
Pruebas de calidad de las semillas
- Prueba de conductividad eléctrica de las semillas
Esta prueba se hace con el propósito de conocer el grado de deterioro de las semillas, partiendo que la pérdida de solidos solubles por parte de las semillas está en correspondencia con el grado de deterioro de las mismas. Para su realización se tomaron cuatro réplicas de 25 semillas por años y se pusieron en remojo en vaso de precipitado con 100 ml de agua destilada durante 24 horas (Soto-Gonzáles et al., 2011).
Se determinó la conductividad de la solución electrolítica (ìS/cm)) con un conductímetro marca HANNA y las mediciones fueron realizada tres veces para confirmar la veracidad de las mediciones.
Prueba bioquímica de tetrazolio
Para la realización de esta prueba se procedió inicialmente a eliminar la testa de las semillas que se encontraban en agua desde el día anterior con el objetivo de facilitar este proceso. Por la baja disponibilidad de semillas este ensayo se realizó con 10 semillas por año. Estas fueron colocadas en placas Petri con 10 ml de cloruro de tetrazolio al 1% y a temperatura ambiente durante 24 horas. Después se enjuagaron las semillas con agua común. Se les realizó un corte longitudinal con la ayuda del bisturí para la observación en el estereoscopio.
Para la evaluación de la prueba de tetrazolio, se tomó como referencia las categorías: semillas con poder germinativo y sin poder germinativo propuestas por Carivita-Abbade y Takaki (2014). Estas se clasifican en función de la coloración de los cotiledones y el embrión:
Cotiledones coloreados mayor o igual 50% y embrión completamente coloreados de rojo: semillas con poder germinativo. Careciendo de poder germinativo en cualquier otra condición.
Prueba bioquímica de índigo
La prueba de índigo carmín ha sido desarrollada desde la mitad del siglo pasado y en especial en tejido animal. Sin embargo, (Benito-Matías et al., 2004) reportan su utilidad en semillas forestales en especial de coníferas. Esta prueba se realiza para determinar el grado de necrosidad de las semillas. En el test se produce una coloración diferencial de los tejidos vivos (incoloros) y muertos (negro) del embrión expuesto al colorante.
Para ello se tomaron 10 semillas de cada año conformando cuatro muestras a las cuales se les quitó la testa luego de haber estado 24 horas en agua. Se colocaron en placas Petri y se le añadió 2 ml del colorante dejándose durante 6 horas en condiciones de oscuridad. Después se enjuagaron las semillas con agua común. Se les realizó un corte longitudinal con la ayuda del bisturí para la observación en el estereoscopio.
La evaluación diferencia tres categorías: vivos: embriones blancos o aquellos que tengan manchas punteadas de color azul que no estén localizadas en la radícula, aunque si el embrión tiene los cotiledones ligeramente teñidos se considera en la categoría de vivo (si están muy teñidos pasan a la categoría de vitalidad limitada); muertos: cuando el embrión tiene la zona de la radícula completamente teñida , cuando las manchas en la radícula son mayores del 50 %, o se observan manchas de color azul intenso de una forma continua y con igual intensidad a lo largo o alrededor del embrión; y de vitalidad limitada: se incluyen todos aquellos embriones que no se pueden englobar en algunos de los grupos anteriores. En este ensayo, se interpretaron como embriones de vitalidad limitada aquellos que tenían zonas teñidas de color azul, aunque no quedaba claro si estaban coloreadas por daño al extraer el embrión o porque realmente eran zonas muertas.
Ensayo de germinación
Este ensayo se realizó durante 40 días, se tomaron un total de 50 semillas de cada año, repartidas en 5 placas Petri con papel de filtro húmedo y no se empleó ningún tratamiento pre-germinativo. El conteo de la germinación se realizó diariamente durante los primeros 30 días de siembra. A partir de los 30 días los conteos se ejecutaron cada 5 días.
Las semillas se contaron como germinada cuando la plántula rompió la cubierta seminal y se elevó inhiesta sobre sí misma. Una vez evaluada como tal, la plántula y su semilla fueron extraídas a fin de evitar errores en los conteos posteriores. Además se procedió a contar los cotiledones de las semillas germinadas y a realizar la prueba de corte final.
Prueba de corte final
Este método se realizó para conocer el estado de las semillas no germinadas (sanas, vanas o enfermas) al concluir el período germinativo y definir de ellas cuáles son las que estando sanas no fueron capaces de completar el proceso germinativo.
Análisis biométrico
Como factor de análisis se consideró el tiempo de almacenamiento, catalogado con el año de colecta. Además se realizó un análisis del comportamiento de la germinación con respecto a las semillas enfermas (prueba de corte final) de los años 2008-2017 evaluados en ese mismo año. Los datos del año 2008 hasta el 2015 fueron tomados del registro de masas semilleras de la estación experimental Viñales y se incluyeron los dos últimos años evaluados (2016-2017).
Para ello se utilizó un gráfico de línea que definiera la tendencia de estos dos parámetros (germinación y semillas enfermas).
Se analizó la influencia del tiempo de almacenamiento con relación a los porcientos de germinación a través de una gráfica de barra para definir la variación entre los años del 2008 al 2016 los cuales fueron evaluados en el mismo año de colecta y vueltos a evaluar pasado 1-3 años.
Por último se procedió a realizar un gráfico de dispersión con el objetivo de relacionar la producción de semillas (kg) datos obtenidos de la estación experimental Viñales con la germinación.
RESULTADOS Y DISCUSIÓN
Pruebas de calidad fisiológica de la semilla
Prueba de conductividad eléctrica de las semillas
En la Figura 1 se presentan los resultados de la prueba de conductividad electrolítica, de acuerdo al fundamento de esta prueba que permite estimar el grado de deterioro de las semillas por la cantidad de electrolitos liberados al agua destilada y esta cantidad indica un mayor deterioro de las membranas celulares y la posible muerte de algunos tejidos e incluso del embrión según Hilmig y Méndez (2011), Soto-González et al., 2011), las semillas del año 2016 son las más afectadas con una medición de 0.55 ìS cm-1.g-1. Esto ocurre debido a diferentes factores tales como deficiencias hídricas, bajas o altas temperaturas, que producen un mayor flujo de pasivo de iones a través de la membrana celular debido a la pérdida de su integridad (Moreno et al., 2001).
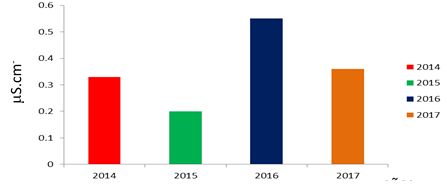
Fig. 1- Resultados de la prueba de conductividad eléctrica.
Soto-Gonzales et al., (2011) reportan que para la especie Corymbia citriodora (Hook.), las semillas de alta calidad fisiológica son las que mostraron valores de 98,8 a 109,7 ìS cm-1 g-1; de media de 113,0 a 119,3 ìS cm-1 g-1, y de menor calidad fisiológica 121,5 a 133,9 ìS cm-1.g-1. Estos autores encontraron un valor correlación lineal de 0,8; entre estos resultados y los de germinación y pruebas de emergencia en viveros, argumentando que es posible entonces emplear el análisis de conductividad dentro de la certificación de semillas en aras de reducir los costos de los ensayos de germinación. De forma general, este ensayo permite pronosticar cierto comportamiento favorable para la germinación en los años 2014 y 2015.
Prueba del tetrazolio
La Figura 2 representa el comportamiento por años de las semillas en función de las categorías de Carivita-Abbade y Takaki (2014). Este ensayo expresa la intensidad respiratoria (Figura 3) de la muestra y esto a su vez se relaciona con el grado de deterioro de sustancias de almacenamiento en la semilla. Se puede observar que las semillas del año 2016 poseen mejores potencialidades para germinar.
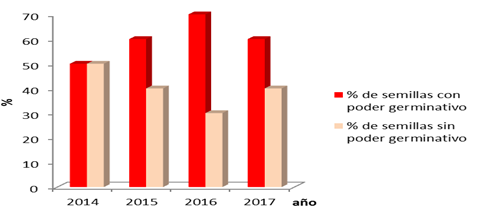
Fig. 2- Comportamiento por año de las semillas bajo el test de tetrazolio.
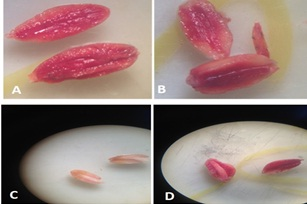
Fig. 3- Prueba de tetrazolio, A y B semillas con poder germinativo, C y D sin poder germinativo.
El año 2016 debería expresar los valores más bajos de semillas con poder germinativo por el deterioro mostrado en el ensayo de conducción electrolítica; sin embargo, estas semillas mayoritariamente categorizaban entre 1 y 2 y tuvieron los mejores resultados germinativos. El ensayo anterior fue congruente con el ensayo de germinación en el año 2016. Por su parte, el año 2014, tenía menor deterioro pero casi el 50% de sus semillas respiraban y por lo tanto estaban aptas.
A veces es difícil la interpretación de los resultados, en este caso, las zonas de las semillas pobremente teñidas por el tetrazolio, puede deberse a errores en la manipulación, siendo complicado interpretar la importancia de zonas que pueden ser básicas para el desarrollo del embrión y posterior germinación de las semillas (Benito-Matías et al., 2004) pues estos están basados principalmente en la experiencia del analizador.
Estas diferencias entre los años, fundamentalmente en proceso de respiración, sustentan que para P. caribaea sea empleada su semilla una vez beneficiada, ya que la disponibilidad de ATP necesario durante la germinación, va a ir disminuyendo con el tiempo. Los resultados reflejaron que el almacenamiento es una de las causas por las que algunas semillas presentan una baja calidad y por tanto no tomaran color, esto será abordado más adelante y podría ser una de las causas.
Prueba de índigo carmín
La Figura 4 muestra que la mayor cantidad de semillas necrosadas se encuentran en el año 2015 y 2017, esto a su vez discrepa con lo que sugiere el test de tetrazolio para estos dos años y es similar con la prueba de conductividad para el 2017.
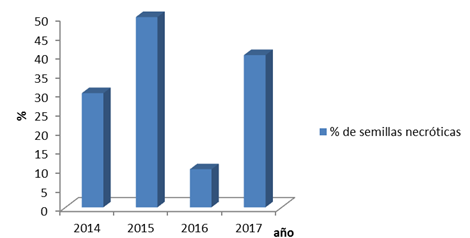
Fig. 4- Resultados de la prueba de índigo carmín.
Los datos muestran que las semillas del año 2016 tuvieron un mejor comportamiento debido a la mínima cantidad de semillas necróticas existentes. Por otra parte se reconoce el gran porcentaje de necrosidad en las semillas del año 2015 lo que corrobora bajo porcentaje de germinación y por tanto lo hace más desfavorable.

Fig. 5- Prueba de índigo carmín, A (semilla necrótica), B (semilla no necrótica).
Si bien esta prueba ha sido utilizada en numerosas especies forestales como puede ser Bombacopsis quinata y Tabebuia rosea (Cordero, 1994); Enterolobium cyclocarpum, Gliricida sepium y Delonix regia (Pivaral-Leiva, 1999), Pinus pinea (Benito-Matías, 2004); Schinopsis balansae (Alzugarayet al., 2005); Acacia melanoxylon (Velásquez, 2006); Aspidosperma sp. (Alzugaray et al., 2006); Rubia fruticosa (Marrero et al., 2007); Maytenusvitis-idaea (Bueno et al., 2009) entre otras; para las especies en estudio no existen reportes acerca de su uso.
Ensayo de germinación
La Figura 6 muestra que los años 2014 y 2016 tuvieron los mayores valores de germinación, los buenos resultados de germinación dependen en gran medida del tiempo de almacenamiento de las semillas ya que estas se van deteriorando, aún más, si no están bajo condiciones favorables (Sotolongo et al., 2010). Pero otro aspecto que influye es el comportamiento de la producción ya que este no se manifiesta de la misma forma todos los años (Sotolongo et al., 2010).
El año 2016 presentó ejemplares con radícula retorcida lo cual representa una evidencia de la presencia de alelos deletéreos (Ledig, 2012, Flores et al., 2005 y 2012).
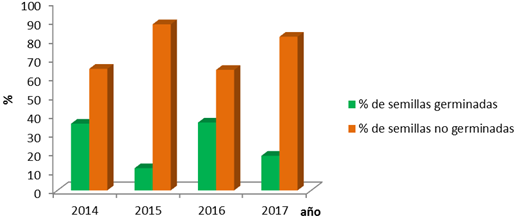
Fig. 6- Resultados del ensayo de germinación.
El ensayo de prueba de corte final (Figura 7) mostró que a pesar de ser el 2015 un año que debería esperarse mejor comportamiento de acuerdo a la prueba de conductividad fue el de mayor cantidad de semillas enfermas razón que determina su baja germinación.
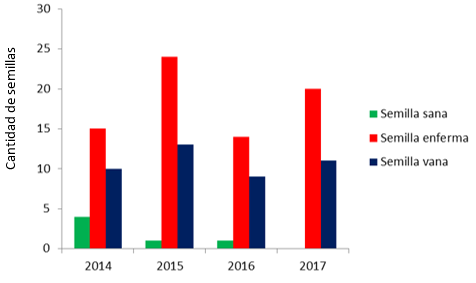
Fig. 7- Prueba de corte final.
El año 2014 consta con mayor cantidad de semillas sanas las cuales podrían haber germinado debido a que su interior (cotiledones y embrión) se encuentran en buen estado y algunas hasta con poder germinativo (coloración verde en su embrión, Figura 8D). Pero no siempre una semilla sana es capaz de germinar, en especial aquellas que se encuentran en áreas con altos niveles de consanguinidad (Lediget al., 2002, Rajona et al., 2000). Sin embargo, el año 2017 no presenta ninguna muestra sana lo que significa que no existía posibilidad de germinación alguna en aquellas semillas que no germinaron.
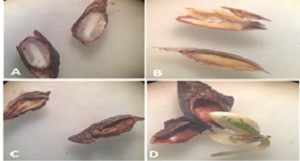
Fig. 8- A (semilla sana). B (semilla enferma). C (semilla vana). D (semilla con poder germinativo).
Comportamiento de la germinación
Cuando se realiza el análisis de comportamiento de la germinación y las semillas enfermas a lo largo de los últimos 10 años, se aprecia que la germinación ha ido disminuyendo desde el 2010 mientras que las semillas enfermas aumentan sosteniblemente (Figura 9). De manera general, se aprecia que los porcentajes de germinación son mucho más bajos que los reportados para la especie (85%) (Varona, 1982; Informe MINAG, 2015).
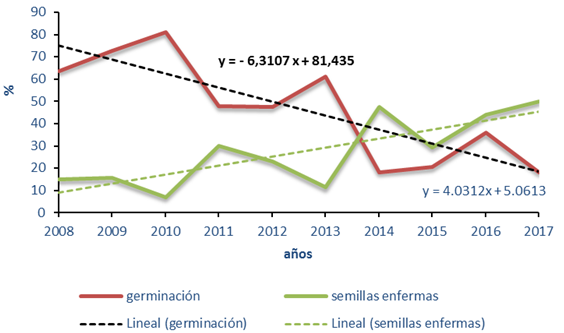
Fig. 9- Comportamiento de las semillas enfermas con respecto a la germinación.
Por otro lado el año 2017 resultó ser el más desfavorable con solo un 18,36 % de germinación y una representación máxima de 50 % de semillas enfermas. No en todos los casos se cumple esta relación pues existen años con menores porcentajes de germinación que otros y sin embargo poseen menos semillas enfermas.
Como se puede apreciar en la Figura 10, la germinación disminuyó con el tiempo de almacenamiento. Al respecto, Ferguson (1995) documenta que la tasa de deterioro, en especial la germinación, depende de las condiciones ambientales durante el almacenamiento y el tiempo en que estas permanecen almacenadas. El primer componente de la calidad que muestra señales de deterioro es el vigor de las semillas, seguido por una reducción en la germinación o de la producción de plántulas normales, y finalmente la muerte de las semillas.
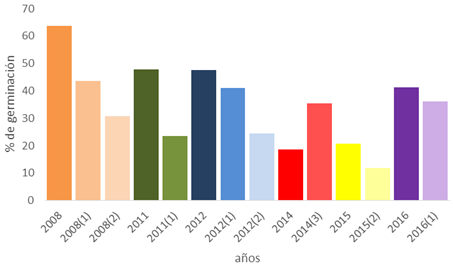
Fig. 10- Comportamiento de la germinación de acuerdo al tiempo de almacenamiento
Acerca de esto, muchos autores plantean que en algunas coníferas la calidad de la semilla se ve mejorada con el almacenamiento (Aitken et al., 2008). Sin embargo, el comportamiento expresado por la especie demuestra que con este se ve reducida la capacidad germinativa al año de colectada. Por otra parte, (Sotolongo et al., 2010) refieren que la edad de la semilla se relaciona con el término longevidad, que es el período que puede ser almacenada sin perder la viabilidad (poder germinativo) y esto determina su calidad fisiológica.
Por lo general, la calidad de la semilla está relacionada con la mayor o menor abundancia anual de producción. En cosechas abundantes los frutos y semillas tienen mejor desarrollo y mejor viabilidad, por lo tanto aumenta la calidad. En años no semilleros la calidad tiende a disminuir. (Sotolongo et al., 2010). Sin embargo, esta relación no es tan estrecha cuando se analiza en función de la germinación (calidad fisiológica) y la producción de la semilla.
CONCLUSIONES
De acuerdo a los diferentes ensayos empleados se comprueba que el tiempo de almacenamiento influye en la calidad de la semilla de P. caribaea,
En la medida que aumenta el tiempo de almacenamiento la calidad fisiológica tiende a disminuir, aunque los lotes de los años de colecta de 2016 y 2014 presentaron mejor comportamiento.
Transcurrido 2 años de almacenamiento la especie pierde cerca del 50% de su capacidad germinativa.
REFERENCIAS BIBLIOGRÁFICAS
Aitken, S., Yeaman, S., Holliday, J., Wang, T., Curtis, S. (2008). Adaptación, migración o extirpación: Impactos del cambio para las poblaciones forestales. Aplicaciones Evolutivas, 1:95-111.
Álvarez-Brito, A. (2003). Estado de la diversidad biológica de los árboles y bosques en Cuba. Documentos de Trabajo: Recursos Genéticos Forestales. FGR/47S. Servicio de desarrollo de Recursos Forestales, Dirección de Recursos Forestales, FAO, Roma.
Alzugaray, C; Carnevale, NJ; Salinas, AR; Pioli, R. (2005). Observations on Seed Quality of Schinopsis balansae Engl., a Tree Species Endemic to South America. Seed Technology, 27(1):9-58.
Alzugaray, C; Carnevale, NJ; Salinas, AR; Pioli, R. (2006). Calidad de semillas de Aspidosperma quebrachoblanco Schlecht. Quebracho, 13pp.
Azcón-Bieto J; Talón M. (2013). Fundamentos de Fisiología Vegetal. 2da Edición. 650pp.
Benito-Matías, L.F.; Herrero, N.; Jiménez, I.; Peñuelas, J.R. (2004). Aplicación de métodos colorimétricos para la determinación de la viabilidad en semillas de Pinus pínea: test del tetrazolio y el índigo carmín. Cuaderno Sociedad Española Ciencias Forestales, 17:23-28.
Betancourt, A. (1987). Silvicultura especial de árboles maderables tropicales. (Ed) Científico-Técnico. Habana. Cuba. 456 pp.
Bueno, M, Alzugaray, C; Giubileo, A.G; Severina, C; Carnevale, N. (2009). Evaluación de la calidad fisiológica de semillas de Maytenus vitis-idaea cultivadas in vitro. BOSQUE 30(3):146-150.
Cordero, C. (1994). Determinación de la viabilidad en semillas de Bombacopsis quinata y Tabebuia rosea y comparación con resultados de viveros. Instituto Tecnológico de Costa Rica. Tesis de especialidad. 64 pp.
Ferguson, J. (1995). An introduction to seed vigour testing. In: Seed vigour testing seminar (Ed. H.A.van de Venter). International Seed Testing Association. Zúrich, Switzerland.14pp.
Hilmig, V., Méndez, N. (2011). Relación entre la conductividad eléctrica, pH del agua de remojo, germinación de semillas y crecimiento de plántulas de maíz (Zea mayz L.) bajo dos condiciones experimentales. Scientia Agropecuaria, 2(4):213- 228.
Ledig, F. T. (2012). Climate change and conservation. Acta Silvatica et Lignaria Hungarica, 8:5774.
Ledig, F. T., Hodgskiss, P. D.; Jacob-Cervantes, V. (2002). Genetic diversity, mating system, and conservation of a Mexican subalpine relict, Picea mexicana Martínez. Conservation Genetics, 3(2):113-122.
Marrero, P; Padilla, D; Valdés, F; Nogales, M. (2007). Comparison of three chemical tests to assess seed viability: the seed dispersal system of the Macaronesian endemic plant Rubia fruticosa (Rubiaceae) as an example. Chemoecology 17(1):47-50.
Moreno-Álvarez, T.; Beníto-Matías, L. F.; Herrero-Sierra, N.; Domínguez-Lerena, S.; Peñuelas-Rubira, J. L. (2001). Estudio de nuevos métodos de determinación de la viabilidad de las semillas forestales: test de electroconductividad e índigo carmín. Comparación con el test del tetrazolio y su aplicación a Pinus pinaster y Pinus halepensis.7pp.
Pérez-Santana, M; González Roque, A.; Echevarría, P.; González, S.; Fuster, J.S. (2011) Mejoramiento Genético de Pinus caribaea Morelet. var. caribaea Barret y Golfari en Cuba. Revista Forestal Baracoa, 30(2).
Pivaral, L. (1999). Desarrollo de patrones de tinción de tetrazolio e índigo carmín, para determinar viabilidad en semilla de Enterolobium cyclocarpum, (Jacq) Griseb. (Conacaste), Gliricida sepium (jacquin) Kunth ex Walper (Madrecacao) y Delonix regia (Bojer) Raf. Fl. Tellur. (Framboyán). Tesis para optar al grado de Ingeniero Agrónomo en Sistemas de Producción Agrícola. Universidad de San Carlos de Guatemala. 92 pp.
Rosa S. D. V. F., Pinho, E. V. R. V.; Vieira, E. V. R. V.; Veiga, R. D. (2000). Eficácia do teste de condutividade elétrica para uso em estudos de danos de secagem em sementes de milho. Revista Brasileira de Sementes 22(1):54-63.
Soto-Gonzales, J. L.; Valiengo-Valeri, S. (2011). Prueba de la conductividad eléctrica en la evaluación fisiológica de la calidad de semillas en Zeyheria tuberculosa. BOSQUE 32(2): 197-202.
Sotolongo-Sospedra, R.; Geada-López, G.; Cobas-López, M. (2010). Fomento Forestal. 235pp.
Varona, J. C. (1982). Fomento de plantaciones de pino. Editorial Pueblo y Educación. Ciudad de la Habana. 101 pp.
Velásquez, L. (2006). Caracterización del banco edáfico de semillas de Acacia melanoxylon R. Brown en dos sitios de la provincia de Concepción. Tesis (Ingeniería Forestal). Universidad de Concepción. Facultad de Ciencias Forestales. Chile. 34 pp.
Copyright (c) Lidia María Dorta Hidalgo
![]()
Este obra está bajo una licencia de Creative Commons Reconocimiento-NoComercial 4.0 Internacional