
ARTÍCULO ORIGINAL
Revista Científico estudiantil Ciencias Forestales y Ambientales.
Enero - Junio 2020; 5(1):1-8

Comparison of the germination behavior of Lysiloma sabicu Benth, in different pregerminative conditions and substrates
Guillermo Jesús Cejas López
Universidad de Pinar del Río "Hermanos Saíz Montes de Oca". Cuba
Recibido: 02 de diciembre 2019
Aprobado: 02 de febrero de 2020
RESUMEN
En el trabajo se evaluó la respuesta de Lysiloma sabicu Benth (L. sabicu) a diferentes tratamientos pregerminativos y su comportamiento en vivero, para facilitar su reproducción por los productores. Se utilizaron 900 semillas, las cuales se dividieron en 9 grupos de a 100 semillas cada uno. De estos grupos seis se sometieron a tratamiento pregerminativo en laboratorio y tres grupos fueron sembradas en 3 tipos de sustratos utilizando la tecnología de viveros en tubetes. El tratamiento pregerminativo en laboratorio que mostró mejores resultados para semillas de la especie L. sabicu fue inmersión en agua a temperatura ambiente por 24 horas, mientras que el tratamiento pregerminativo de sumersión en agua hirviendo durante 30 segundos, mostró el mejor resultado para estas semillas en el sustrato compuesto por la mezcla de humus de lombriz en una proporción de 30%, compost en un 20% y estiércol vacuno en un 50%.
Palabras clave: Lysiloma sabicu; tratamiento pre-germinativo; germinación; vivero.
ABSTRACT
The investigation evaluated the response of Lysiloma sabicu Benth (L. sabicu) to different pregerminative treatments and their behavior in nursery, to facilitate their reproduction by the producers. 900 seeds were used, which were divided into 9 groups of 100 seeds each. Of these groups, six underwent pregerminative treatment in the laboratory and three groups were seeded in 3 types of substrates using tube nursery technology. The pregerminative laboratory treatment that showed better results for seeds of the L. sabicu species was immersion in water at room temperature for 24 hours, while the pregerminative treatment of immersion in boiling water for 30 seconds, showed the best result for these seeds in the substrate composed of the mixture of earthworm humus in a proportion of 30%, compost in 20% and cattle dung in 50%.
Key words: Lysiloma sabicu; pre-germination treatment; germination; nursery.
INTRODUCCIÓN
Los bosques tropicales son bien conocidos por su alta riqueza de especies de plantas. En este ambiente, los árboles producen semillas que muestran una amplia diversidad en: masas, formas, estructuras de dispersión, composición química, contenido de agua, naturaleza de las reservas, mecanismos de dormancia, y patrones de germinación y de longevidad (Sospedra, et al., 2010) Esta gran variabilidad en los rasgos morfológicos y fisiológicos de las semillas se debe fundamentalmente a las respuestas de las plantas a la presión del ambiente donde evolucionaron, aunque no todos los rasgos de las semillas tienen un valor adaptativo en el ambiente ecológico actual.
Lysiloma sabicú Benth (L. sabicu) (Fors, 1965), es un árbol de gran utilidad, por la calidad de su madera, es explotado indiscriminadamente por el hombre por su utilización tanto en la carpintería pesada como ligera, esto sumado a sus bajos porcentajes de germinación ha provocado que la especie afronte una situación de peligro. Previendo que una especie de alto valor económico desaparezca, la especie L. sabicú se encuentra dentro de los planes de reforestación de Cuba. De ahí que el objetivo de este trabajo sea evaluar el comportamiento de la germinación de las semillas de la especie L. sabicú en diferentes condiciones pregerminativas y sustratos.
MATERIALES Y MÉTODOS
Localización del experimento
Las investigaciones se realizaron en el área del vivero docente que se encuentra en el edificio de laboratorio de la sede universitaria "Hermanos Saiz Montes de Oca" con una duración de dos meses. Paralelo a este se desarrollaron los experimentos determinados para el laboratorio de silvicultura de la misma institución, con una extensión de un mes, para un periodo total de experimento de dos meses ininterrumpidos, comenzando el día 20 de febrero hasta el 20 de abril de 2019.
Material de reproducción
Las semillas recolectadas de ocho árboles con las características fenotípicas adecuadas para tomarlos como progenitores de un saludable lote de semillas.
Las semillas recolectadas se sometieron a una prueba de corte inicial y una final en el cual se determinaron la cantidad de semillas enfermas, vanas y buenas; además se determinó el número de semillas por Kg de estas.
Se utilizaron 900 semillas, las cuales se distribuyeron en lotes de 100 por experimento. En laboratorio se montó el tratamiento de escarificación térmica (ET), aplicando tiempos de sumersión en agua hirviendo de 15, 20 y 30 segundos, Dejándolas refrescar posteriormente durante 5 minutos. El tratamiento de sumersión en agua a temperatura ambiente (STA) se empleó en sus variantes de tiempos de 24, 48 y 72 h.
En estas condiciones se utilizaron cápsulas de Petri previamente esterilizadas en autoclave y con papeles de filtro para absorber, mantener y controlar la humedad.
Se colocaron 50 semillas en cada placa, sobre el papel de filtro previamente humedecido. De modo que para cada tratamiento fueron utilizados dos cápsulas de Petri y un total de 100 semillas.
En las condiciones de vivero se utilizó la tecnología de tubetes (Figura 1). Las 300 semillas fueron sumergidas durante 30 segundos en agua hirviendo, antes de ser sembradas (Betancourt, 1987). Se prepararon tres tipos de sustratos con la utilización de diferentes proporciones de componentes orgánicos distintos para cada uno como aparece a continuación:
Sustrato 1 (S1): compuesto por humus de lombriz en una proporción de 50%, corteza de pino compostada en un 20% y estiércol vacuno en un 30%.
Sustrato 2 (S2): compuesto por humus de lombriz en una proporción de 30%, compost en un 20% y estiércol vacuno en un 50%.
Sustrato 3 (S3): compuesto por compost en una proporción de 50%, corteza de pino compostada en un 20% y estiércol vacuno en un 30%.
Se utilizaron 50 tubetes por sustratos para un total de 150 tubetes. En cada tubete se depositaron 2 semillas para un total de 300 semillas sembradas. Luego de montado los experimentos se monitorearon con una frecuencia diaria por la duración total de los mismos. Todos los datos recopilados fueron registrados en la libreta de notas para su posterior introducción en una hoja de datos Excel para su procesamiento estadístico.

Fig. 1- Tubetes utilizados en el vivero
Análisis estadístico
Los datos fueron sometidos a un análisis de regresión para ajustar los datos a una función matemática conocida para describir el comportamiento de la germinación en función del tiempo.
RESULTADOS Y DISCUSIÓN
En la prueba de corte inicial se obtuvo un 53% de semillas buenas, 45% de enfermas y un 2% de vanas. En la prueba de corte final se obtuvo un 10% de semillas buenas, 70% de enfermas y un 20% de vanas. La cantidad de semillas por Kg fue de 34400.
De las 900 semillas sometidas a los diferentes tratamientos pregerminativos, germinaron 176 semillas para un 19,6 % de germinación total siendo valores inferiores a los planteados por Betancourt (1987) y Fors (1965), quienes afirman que esta especie presentan bajos porcentajes de germinación con una media del 40% (Tabla 1).
Tabla 1- Porcentaje de germinación de las semillas de L. sabicu germinadas con los diferentes tratamientos pregerminativos y sustratos
Tratamientos |
Semillas |
% Germinación |
|
Sembradas |
Germinadas |
||
ET 15s |
100 |
10 |
10,0 |
ET 20s |
100 |
11 |
11,0 |
ET 30s |
100 |
11 |
11,0 |
STA 24h |
100 |
40 |
40,0 |
STA 48h |
100 |
32 |
32,0 |
STA 72h |
100 |
9 |
9,0 |
S1 |
100 |
18 |
18,0 |
S2 |
100 |
27 |
27,0 |
S3 |
100 |
20 |
20,0 |
Total |
900 |
176 |
19,6 |
Leyenda: ET (escarificación térmica), STA (sumersión a temperatura ambiente), S1 (sustrato1), S2 (sustrato2), S3 (sustrato3)
Germinación de la semilla en condiciones de laboratorio
En el caso de las semillas sometidas al tratamiento de escarificación térmica (ET) se obtuvo que las que recibieron el tratamiento de 15s comenzaron a germinar a partir del quinto día siendo el día 13 el día del vigor con cinco semillas germinadas esto concuerda con Sablón (1984), quien refiere que las semillas de L. sabicu inician su germinación entre los cinco y ocho días de sembradas. En el resto de los tratamientos (20s y 30s) comienza a los 10 días coincidiendo con lo planteado por Betancourt en 1987 y Fors en 1965 los cuales plantean que la germinación de esta especie comienza entre los ocho y diez días.
En el caso de las semillas sometidas al tratamiento de sumersión en agua a temperatura ambiente durante diferentes periodos de tiempo en las tres situaciones (24h, 48h y 72h) las semillas comenzaron a germinar el primer día después de sembrada destacándose el STA 24h que el día de germinación concuerda con el día del vigor con siete semillas; el tratamiento STA 48h presentó un vigor al segundo día con siete semillas y el de STA 72h no presentó un día de vigor marcado siendo este comportamiento el primero en ser registrado.
Una vez concluida la recolección y procesado de los datos se identificó que los lotes sometidos a los diferentes tratamientos de escarificación térmica mostraron porcentajes de germinación de 10%, el de 15 segundos y 11% los de 20 y 30 segundos de sumersión. Los lotes sometidos a sumersión en agua a temperatura ambiente (STA) por 24, 48 y 72h mostraron un por ciento de germinación de 40%, 32% y 9% respectivamente (Tabla 1).
Se obtuvo que el lote sometido al tratamiento pregerminativo de STA por 24h presentó el mayor por ciento de germinación con un 40% (Figura 2) y el menor por ciento se observa en el lote sometido al tratamiento de STA por 72 h con un 9%.
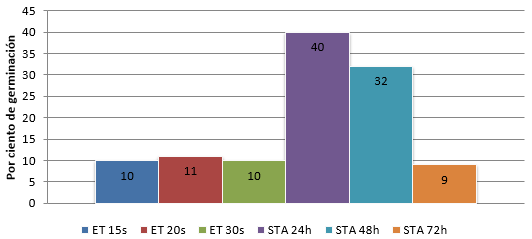
Fig. 2- Porcentajes de germinación de L. sabicu en laboratorio
Leyenda: ET (escarificación térmica), STA (sumersión a temperatura ambiente)
Análisis de regresión en la caracterización de la germinación
Tratamiento Escarificación térmica:
A partir del análisis de regresión realizado teniendo en cuenta el proceso de germinación en función del tiempo, se obtuvieron los siguientes modelos matemáticos:
ET 15s: Logistic Model: y=a/ (1+b*exp(-cx))
ET 20s: MMF Model: y=(a*b+c*x^d)/(b+x^d)
ET 30s: Polynomial Fit: y=a+bx+cx^2+dx^3
Estos modelos permitieron explicar el comportamiento el proceso de germinación de las semillas para el tratamiento de escarificación térmica durante el periodo de germinación, obteniéndose un periodo de reposo, aumento exponencial y luego reposo nuevamente para los tratamientos de ET 15s y ET 20s y un comportamiento más errático al tratamiento de 30s donde a mitad del proceso de germinación se detiene y luego recomienza otra vez. Finalmente se puede determinar que el tratamiento con una germinación más uniforme fue de las plantas sometidas al tratamiento ET de 20s (Figura 3).
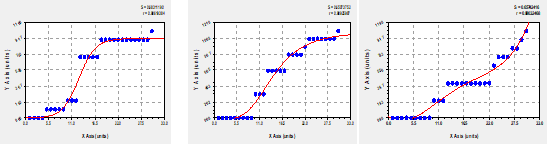
Fig. 3- Modelos matemáticos que caracterizan la germinación en el tratamiento de
escarificación térmica durante 15s, 20s, 30s respectivamente
Tratamiento de sumersión en agua a temperatura ambiente
A partir del análisis de regresión realizado teniendo en cuenta el proceso de germinación en función del tiempo, se obtuvieron los siguientes modelos matemáticos:
STA 24h: Exponential Association (3): y=a(b-exp(-cx))
STA 48h: 4th Degree Polynomial Fit: y=a+bx+cx^2+dx^3...
STA 72h: Logistic Model: y=a/(1+b*exp(-cx))
Como se muestran en la Figura 4 se muestra el comportamiento de la semilla bajo estas condiciones evidenciándose un período de aumento exponencial de la germinación desde el inicio de los experimentos hasta que eventualmente se detiene al final de estos obteniéndose que el tratamiento más uniforme y duradero en su desarrollo es el tratamiento de STA por 24h (Figura 7).
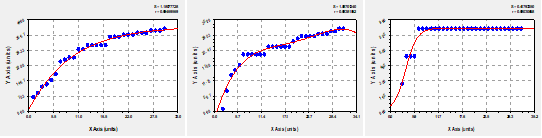
Fig. 4- Modelos matemáticos que caracterizan la germinación en el tratamiento de sumersión
en agua a temperatura ambiente durante 24h, 48h y 72h respectivamente
Germinación en condiciones de vivero
El tratamiento S1 (compuesto por humus de lombriz en una proporción de 50%, corteza de pino compostada en un 20% y estiércol vacuno en un 30%) comenzó la germinación el día 10 después de la siembra lográndose el día de vigor el día 20 con cuatro semillas. El tratamiento S2 (compuesto por humus de lombriz en una proporción de 30%, compost en un 20% y estiércol vacuno en un 50%) comenzó la germinación el día10 después de la siembra lográndose el día de vigor al día 42 con cinco semillas. El tratamiento S3 (compuesto por compost en una proporción de 50%, corteza de pino compostada en un 20% y estiércol vacuno en un 30%) comenzó la germinación el día 15 con dos semillas y no se obtuvo día de vigor.
Una vez terminada la recolección y procesamiento de datos se obtuvo que en el vivero los porcentajes de germinación en los diferentes sustratos se comportaron de la siguiente forma: S1 germinó un 18%, S2 un 27% y en S3 germinó el 20% (Tabla 1).
Al comparar los resultados se evidenció que las plántulas que germinaron en el sustrato S2 mostraron el mayor por ciento y S1 el menor con 27 y 18% respectivamente (Figura 5).
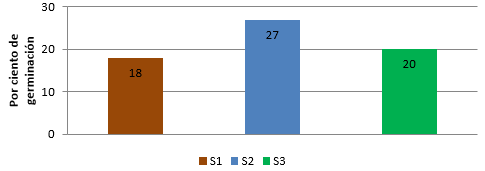
Fig. 5- Porcentaje de germinación de L. sabicu en los tres sustratos
El hecho de que las semillas del tratamiento S2 hayan tenido un mayor porcentaje de germinación pudiera estar dado por el mayor contenido de materia orgánica, que aumenta el contenido de agua y esta es la condición necesaria para la germinación. Resultados similares obtuvieron Arteaga-Crespo et al., (2013), cuando incluyeron compost y lombricomposta, en el caso del contenido de MO en el sustrato, corroborando lo que plantean otros autores cuando afirman que el efecto de la incorporación de composta y lombricomposta impacta directamente en el contenido de MO de los sustratos manifestándose en una menor densidad aparente y, por ende en una alta fertilidad natural.
También el humus de lombriz ejerce una acción favorable en el aumento de la permeabilidad y de la capacidad de retención de agua siendo la humedad uno de los factores más importantes en el proceso de germinación de las semillas (Alonso-López et al. 2013; Arteaga-Crespo et al. 2014).
El otro sustrato que mejores resultados obtuvo fue el S3, lo que puede ser consecuencia de la elevada porosidad y capacidad de retención de agua que aporta la corteza compostada, ya que por un lado es necesaria la presencia de agua para la germinación, la que debe encontrarse disponible en el substrato y por otro lado es necesario que el drenaje sea suficiente para que no disminuya la provisión de oxígeno en el proceso de respiración de la semilla.
Análisis de regresión en la caracterización de la germinación
A partir del análisis de regresión realizado teniendo en cuenta el proceso de germinación en función del tiempo, se obtuvieron los siguientes modelos matemáticos:
S1: 4th Degree Polynomial Fit: y=a+bx+cx^2+dx^3...
S2: 3rd degree Polynomial Fit: y=a+bx+cx^2+dx^3...
S3: MMF Model: y=(a*b+c*x^d)/(b+x^d)
Como se muestran en la Figura 6 se puede evidenciar el proceso de germinación de las semillas para los distintos sustratos durante el periodo de germinación, obteniéndose un periodo de crecimiento exponencial durante todo su proceso de germinación para los sustratos S2 y S3 y para el sustrato S1 presenta un periodo de reposo entre los días 30 y retomando su germinación sobre el día 50.
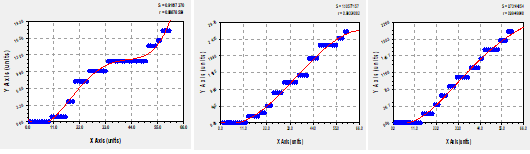
Fig. 6- Modelos matemáticos que caracterizan la germinación en el experimento de vivero
con sustratos S1, S2 y S3.
De modo general, el tratamiento pregerminativo en el que mejor por ciento de germinación se obtuvo de todos los realizados es en el que se sumergieron las semillas en agua a temperatura ambiente por 24h y en el vivero el sustrato donde se obtiene el mejor por ciento de germinación es la S2 compuesto por humus de lombriz en una proporción de 30%, compost en un 20% y estiércol vacuno en un 50%.
REFERENCIAS BIBLIOGRÁFICAS
Alonso-López, M.R; Arteaga-Crespo, Y.; Carballo-Abreu, L.; Geada-López, G.; García-Quintana, Y.; Castillo-Martínez, I. (2013). Efecto del biocarbón en las propiedades físicas de diferentes sustratos orgánicos. Revista Cubana de Ciencias Forestales, 1(1), 12-22.
Arteaga-Crespo, Y.; Geada-López, G.; García-Quintana, Y.; Caballo-Abreu, L. (2013). Evaluación del aporte nutricional de diferentes sustratos a plantas de Talipariti elatum cultivada en tubetes. Revista Latinoamericana de Recursos Naturales, 9(2), 184-194.
Arteaga-Crespo, Y.; Geada-López, G.; García-Quintana, Y.; Alonso-López, M.; Castillo-Martínez, I. (2014). Mejoramiento de las propiedades físicas de los sustratos con biocarbón. Revista Forestal Baracoa, 33(1), 25-32
Betancourt, A. (1987). Silvicultura Especial de árboles maderables tropicales. La Habana: Editorial Científico-Técnico.
Fors, A. J. (1965). Manual de Silvicultura. La Habana, Cuba. IV Edición.
Sablón, M. (1984). Dendrología. La Habana, Cuba Editorial: Pueblo y Educación
Copyright (c) Guillermo Jesús Cejas López
![]()
Este obra está bajo una licencia de Creative Commons Reconocimiento-NoComercial 4.0 Internacional